2. Молекулярная физика
 Читать 0 мин.
Читать 0 мин.
2.4. Фазовые переходы
С течением времени в любом теле или системе тел устанавливается тепловое равновесие ― равенство температур. Если два тела с равными температурами находятся в контакте, между ними не будет происходить обмен тепловой энергией. Если в контакте находятся горячее и холодное тело ― то более нагретое тело будет отдавать энергию, остывая, а более холодное ― получать тепловую энергию, нагреваясь. Процесс теплообмена будет проходить до тех пор, температура двух тел не станет одинаковой.
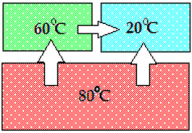
Пример теплообмена для системы из трех тел:
|
Горячее тело передает тепловую энергию холодному телу: Тело с температурой 60°С горячее тела с температурой 20°С и передает ему тепло; тело с температурой 80°С передает тепло двум другим телам ― с температурами 60° и 20°С |
Спустя некоторое время все три тела придут в состояние теплового равновесия: их температура станет одинаковой, а передача тепла от одного тела к другому прекратится. |
Чем выше температура тела, тем выше скорость хаотичного движения молекул тела. При нагревании тела кинетическая энергия движения его молекул увеличивается, т. к. кинетическая энергия молекулы прямо пропорциональна квадрату ее скорости.
Существуют четыре фазовых (агрегатных) состояния вещества: кристаллическое, аморфное, жидкое и газообразное. Вещество в аморфном состоянии внешне твердое, но его внутренняя структура такая же, как у жидкостей.
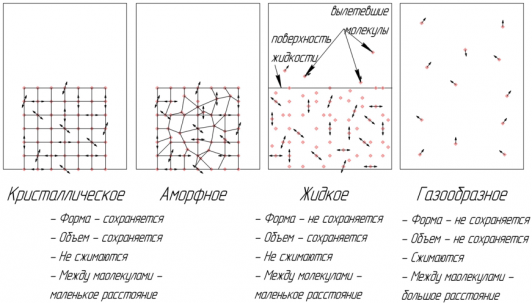
Кристаллические и аморфные тела сохраняют свою форму и объем, не сжимаются.
Жидкости сохраняют свой объем, но не сохраняют форму, практически не сжимаются.
Газы занимают весь предоставляемый объем. Газы сжимаются за счет того, что расстояние между молекулами газа намного превышает размеры самих молекул.
Структура кристаллических тел обладает дальним порядком ― расположение молекул повторяется практически без изменения на расстояниях, превышающих размеры молекул.
Структура аморфных тел и жидкостей обладает ближним порядком ― расположение повторяется только на расстояниях, соизмеримых с размерами молекулы.
Молекулы газов не связаны друг с другом и порядком расположения молекул не обладают.
Чем выше температура ― тем с большей скоростью колеблются молекулы твердых тел и жидкостей относительно места своего положения. При повышении температуры газов увеличивается скорость свободно перемещающихся в объеме молекул.
Так как у всех молекул скорость движения разная, некоторые молекулы жидкости оказываются достаточно быстрыми, чтобы преодолеть притяжение всех других молекул и вылететь за пределы поверхности жидкости ― из-за вылета молекул происходит постепенно испарение жидкости из открытого сосуда.
Фазовые переходы ― это переходы вещества из одного агрегатного состояния в другое.
Плавление ― переход тела из кристаллического агрегатного состояния в жидкое. При этом вся подводимая тепловая энергия, как только твердое тело нагрето до температуры плавления, тратится на разрыв кристаллической решетки. Потенциальная энергия молекул вещества увеличивается, а кинетическая остается постоянной. Во время плавления не смотря на подвод тепла температура тела остается неизменной.
Кристаллиацзия ― переход тела из жидкого агрегатного состояния в кристаллическое. Это процесс, обратный процессу плавления, он начинается, когда температура тела опускается до точки кристаллизации (численно она равна точке плавления). Во время кристаллизации тепловая энергия телом выделяется, а потенциальная энергия молекул вещества уменьшается за счет того, что образуется кристаллическая решетка. Температура тела во время кристаллизации постоянна.
Кипение (парообразование) ― переход тела из жидкого агрегатного состояния в газообразное. Кипение начинается, как только температура тела достигла температуры кипения. После этого температура тела не увеличивается, а вся подводимая тепловая энергия расходуется на разрыв связей между молекулами жидкости и увеличение расстояния между ними. Во время кипения переход в газообразное состояние происходит во всем объеме кипящей жидкости.
Конденсация ― переход тела из газообразного агрегатного состояния в жидкое. Это процесс обратный кипению, он начинается, как только температура газа понизилась до точки кипения. Во время конденсации выделяется тепловая энергия, а потенциальная энергия молекул газа уменьшается за счет образования межмолекулярных связей. Температура во время процесса конденсации постоянна.
В некоторых случаях возможна сублимация ― переход сразу из твердого состояния тела в газообразное, и конденсация из газообразного состояния в твердое.
Внутренняя энергия вещества U состоит из кинетической энергии его молекул (или атомов) EK и потенциальной энергии их связей EП.
U = EK + EП.
Кинетическая энергия вещества увеличивается во время нагревания, и уменьшается во время остывания. Потенциальная энергия вещества увеличивается во время плавления и кипения, и уменьшается во время кристаллизации и конденсации. Следовательно, внутренняя энергия вещества увеличивается во время его нагревания, плавления и кипения ― Q ˃ 0, и уменьшается во время остывания, кристаллизации и конденсации ― Q ˂ 0.
|
Процесс |
Количество теплоты Q |
Кинетическая энергия молекул EK |
Потенциальная энергия связи между молекулами EП |
|
Нагревание |
Увеличивается |
Увеличивается |
Не изменяется |
|
Плавление |
Увеличивается |
Не изменяется |
Увеличивается |
|
Парообразование |
Увеличивается |
Не изменяется |
Увеличивается |
|
Остывание |
Уменьшается |
Уменьшается |
Не изменяется |
|
Кристаллизация |
Уменьшается |
Не изменяется |
Уменьшается |
|
Конденсация |
Уменьшается |
Не изменяется |
Уменьшается |
Количество теплоты, затрачиваемое на изменение температуры тела равно:
Q = cm∆T, где
Q ― количество теплоты, которое вещество получило (при нагревании) или отдало (при охлаждении), [Дж],
с ― удельная теплоемкость вещества, [Дж/кг∙К],
m ― масса вещества, [кг],
∆Т ― изменение температуры вещества, [C].
Удельная теплоемкость вещества ― c [Дж/кг∙К] ― показывает, какое количество теплоты нужно затратить на то, чтобы нагреть 1 кг вещества на 1 С или 1 К. Для разных веществ, и для разных агрегатных состояний одного и того же вещества, удельная теплоемкость различна. Такое же количество теплоты выделяется при охлаждении 1 кг вещества на 1 С.
Количество теплоты, которое затрачивается на переход вещества из твердого в жидкое состояние (плавление и кристаллизация):
Q = λm, где
Q ― количество теплоты, которые вещество получило (при плавлении) или отдало (при кристаллизации), [Дж],
λ ― удельная теплота плавления, [Дж/кг],
m ― масса вещества, [кг].
Количество теплоты, которое затрачивается на переход вещества из жидкого в газообразное состояние (парообразование и конденсация):
Q = rm, где
Q ― количество теплоты, которые вещество получило (при кипении) или отдало (при конденсации), [Дж],
r ― удельная теплота парообразования, [Дж/кг],
m ― масса вещества, [кг].
На рисунке показаны тепловые процессы при нагревании и охлаждении тела.
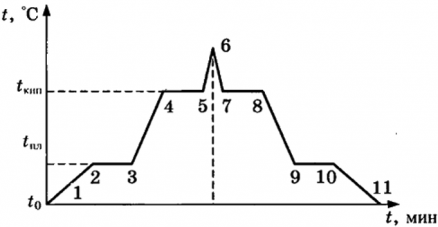
1-2 ― нагревание твердого тела от температуры t0 до температуры плавления tпл;
2-3 ― плавление твердого тела. Тепло к телу подводится, но температура тела остается постоянной и равной tпл;
3-4 ― нагревание жидкости от температуры плавления tпл до температуры кипения tкип;
4-5 ― парообразование. Тепло к телу подводится, но температура остается постоянной и равной tкип;
5-6 ― нагревание газа;
6-7 ― охлаждение газа;
7-8 ― конденсация жидкости из газа. Тело выделяет тепло, температура его остается постоянной и равной tкип;
8-9 ― охлаждение жидкости, от температуры кипения tкип до температуры плавления tпл;
9-10 ― кристаллизация. Тело выделяет тепло, температура его постоянна и равна tпл;
10-11 ― охлаждение твердого тела от tпл до t0.
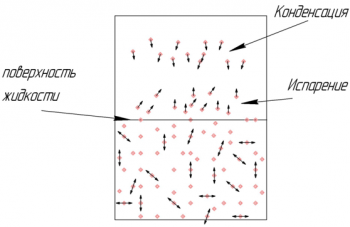
Испарение ― превращение жидкости в газ при температуре ниже температуры кипения. Испарение происходит из-за того, что скорости теплового движениях всех молекул в жидкости различны, и всегда есть некоторое количество молекул, скорость движения которых достаточно большая, чтобы преодолеть притяжение всех остальных молекул и выскочить за пределы поверхности жидкости.
Испарение происходит только с поверхности жидкости и существует при любой температуре (кипение ― во всем объеме жидкости и только при температуре кипения). При испарении жидкость покидают наиболее быстрые молекулы, следовательно, остаются более медленные ― а значит, общая температура жидкости понижается.
Испарение происходит тем быстрее, чем выше температура жидкости (больше быстрых молекул), чем больше площадь открытой поверхности жидкости и чем ниже влажность воздуха.
Процесс, обратный испарению, когда молекулы из газообразного состояния переходят в жидкое, также называется конденсацией.
Насыщенный пар ― это пар, находящийся в динамическом равновесии со своей жидкостью: с поверхности жидкости испаряется столько же молекул, переходя в газ, сколько из газа конденсируется молекул, переходя в жидкое состояние.
Давление насыщенного пара не зависит от объема, который он занимает. Давление насыщенного пара увеличивается только за счет повышения его температуры (чем выше температура газа ― тем быстрее скорость молекул).
Относительная влажность воздуха равна:
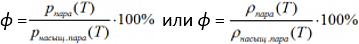 , где
, где
p пара (Т) ― давление пара при данной температуре Т, [Па],
p насыщ. пара (Т) ― давление насыщенного пара при данной температуре, [Па],
ρ пара (Т) ― плотность пара при данной температуре, [кг/м3]. Плотность пара также называют абсолютной влажностью воздуха,
ρ насыщ. пара( Т) ― плотность насыщенного пара при данной температуре, [кг/м3].
Давление и плотность насыщенного пара обычно определяются по таблицам.
Точка росы ― температура, при которой пар, находящий в воздухе, становится насыщенным. При этой температуре относительная влажность воздуха равна 100%.
Относительная влажность воздуха не может превышать 100% ― при ϕ = 100% весь пар в воздухе является насыщенным паром ― т. е. сколько молекул испаряется с поверхности жидкости, столько и конденсируется.